La geometría molecular es campo de la química encargada de estudiar los enlaces atómicos y cómo una determinada estructura molecular puede dar propiedades únicas a los elementos que componen toda la materia conocida. Gracias a este conocimiento los seres humanos se han convertido en verdaderos arquitectos de la materia.
Ciencias fácticas:
Cuáles son, clasificación, ejemplos y qué objeto estudian las ciencias empíricas o factuales
¿Qué es la geometría molecular?
La geometría molecular es el nombre que recibe la disposición teórica de los átomos que conforman una molécula, vista desde un plano 3D. Esta estructura o disposición de los átomos determinan el comportamiento de los compuestos, tales como su punto de ebullición, densidad y demás.
Los isómeros estructurales, por ejemplo, son compuestos que tienen las mismas moléculas. Pero, ya que sus átomos tienen enlaces orgánicos diferentes, es decir, tienen una geometría molecular particular, presentan comportamientos o propiedades distintas.
Por esta razón, es importante conocer los tipos de geometrias moleculares de algunos compuestos.
Antecedentes de la geometría molecular
Unos de los primeros antecedentes conocidos son los de John Dalton y Joseph Louis Gay-Lussac, quienes propusieron las bases de los estudios moleculares, junto a sus respectivos modelos atómicos.
Para este punto, alrededor del siglo XIX, no se había diferenciado aun entre átomos y moléculas.
Años más tarde, Amedeo Avogadro fue quien separó los conceptos, estableciendo que los átomos conforman toda la materia conocida, pero que las distintas uniones de estos átomos les dan estructuras y propiedades a las moléculas.
Finalmente, en 1850 Friedich August Kekulé fue quien descompuso por primera vez una estructura química (la del benceno), abriendo así paso al estudio de la geometría eléctrica y molecular (moderna).
Geometría molecular actual
En la actualidad se utiliza la tabla de geometrías moleculares de Nevil Sidgwick y Herbert Powell, una propuesta de 1940, también conocida como la Teoría de Repulsión de Pares de Electrones de la Capa de Valencia, teoría de Gillespie o TRPECV.
Gracias a la aplicación de esta metodología, junto a los conceptos de la estructura de Lewis, se puede determinar con bastante precisión la geometría química de un compuesto.
Esta teoría se basa en que los átomos que están unidos a través de enlaces covalentes se repelen entre sí dentro de una estructura, por lo que se ordenaran de manera tal que consigan la máxima separación posible entre ellos.
Elementos que conforma la geometría molecular
La geometría de moléculas está conformada por un átomo central, un grupo de átomos unidos, pares de electrones libres y las fuerzas que configuran la geometría de la unión (longitud, ángulo y torsión), es decir AXnEm.
Átomo central
En lo que respecta los enlaces covalentes, el átomo central es aquel que marca el punto central de la estructura, siendo además al que el resto de átomos se unen. Dada la tendencia simétrica de las estructuras atómica (a nivel teórico) se deben seguir algunas reglas para determinar cuál sería este átomo central. Por ejemplo:
- El átomo central es único. Es decir, no hay dos átomos de su mismo tipo en la misma molécula.
- Oxígeno e hidrógeno no pueden ser átomos centrales.
- Suele elegirse el elemento menos electronegativo.
- El carbono suele preferirse como átomo central.
Átomos unidos
Los átomos se unen siguiendo un principio de estabilidad energética. Al unirse, comparten algunos de los electrones que poseen en su última capa de valencia. El estado más estable se consigue cuando el número de electrones asciende a ocho (8).
Al unirse a un átomo central, usualmente el menos electronegativo, crean una estructura descrita por la geometría molecular, que incide directamente en las propiedades físico-químicas de las moléculas.
Ángulo de enlace
La estructura geométrica de una molécula se representa en un plano tridimensional. Es decir, se utilizan figuras para representar tanto a los átomos unidos a un átomo central, como a sus respectivos enlaces.
Los átomos unidos siguen el principio de repulsión de cargas, es decir, tratan de estar separados tanto como les sea posible, consiguiendo una forma simétrica.
La forma geométrica descrita por los enlaces se mide en ángulos de separación, los cuales deben ser similares entre todos los puntos.
Ángulo de torsión
Cuando una molécula aumenta el número de elementos unidos al átomo central, ya sean otros átomos o pares de electrones libres, las figuras comienzan a describir estructuras geométricas en tres dimensiones (como una pirámide, por ejemplo).
De esta manera, en los compuestos formados por moléculas de cuatro átomos enlazados en línea, se genera un ángulo de torsión entre los planos bidimensionales y tridimensionales.
Descubriendo la geometría de las moléculas
Para determinar la geometría molecular de los átomos se necesita conocer previamente la estructura de Lewis del elemento en cuestión.
Primero se parte de una fórmula química y luego se establece el número de coordinación del átomo central, el cual se calcula sumando el número de electrones unidos, con el número de pares de electrones libres.
Se puede tomar de ejemplo el bromuro de mercurio, cuya fórmula química es HgBr2. Tomando como átomo central aquel que es único dentro de la fórmula, se establece entonces el mercurio (Hg) como base, al que se le unen dos átomos de bromo. De tal forma que:
(Br – Hg – Br)
Nótese que hay un ángulo de 180° entre los átomos de bromo debido a que esta es la máxima distancia simétrica en la que pueden configurarse para cumplir con la fuerza mínima de repulsión.
Al no haber pares de electrones libres, el número de coordinación es dos y la geometría molecular es lineal, en cuanto describe una línea recta.
Ejemplos de geometría molecular
Las estructuras moleculares pueden describirse de muchas maneras como, por ejemplo, según la geometría molecular y polaridad de sus compuestos:
Lineal (AX2E0)
La geometría lineal es aquella en la que los átomos ligados describen un ángulo de 180°, es decir, describen una línea recta en un plano bidimensional. Un ejemplo de esta puede ser el CO2. Esta es de las geometrías moleculares más simples después de la molécula diatómica.
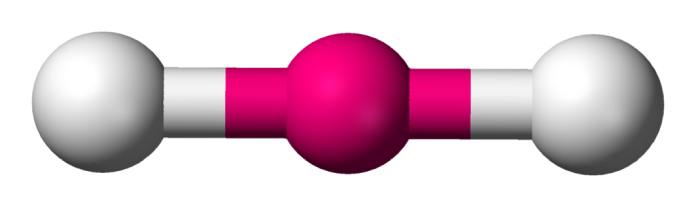
Angular (AX2E1)
La geometría angular describe una figura ligeramente curva, con un ángulo bidimensional de 120° entre los átomos unidos aproximadamente. Esto suele deberse a la presencia de un par de electrones libres. A pesar de que estos no se toman en cuenta para el cálculo de la geometría, sí afectan su forma final, así como las propiedades de las moléculas. Un ejemplo de esto puede ser el SO2.
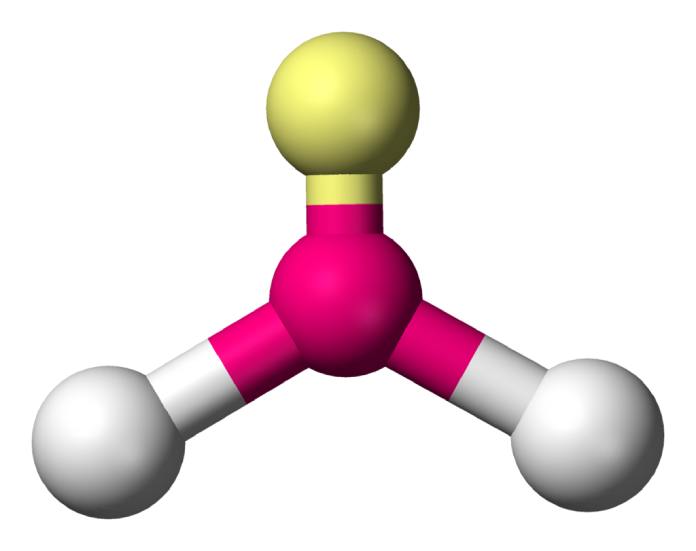
Angular agudo (AX2E1)
La geometría molecular angular aguda es aquella que cuenta con dos pares de electrones libres. Estos empujan a los átomos en un ángulo más pequeño, cercano a los 104°. La geometría molecular del H2o tiene esta distribución.
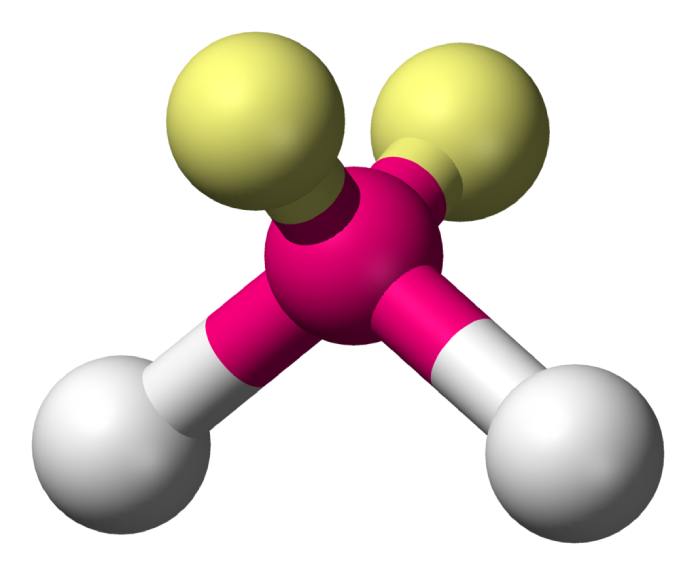
Trigonal plana (AX3E0)
La geometría trigonal plana es aquella que describe una figura simétrica de tres elementos unidos a un átomo central con una separación aproximada de 120° entre ellos. El SO3 es un ejemplo de esta.
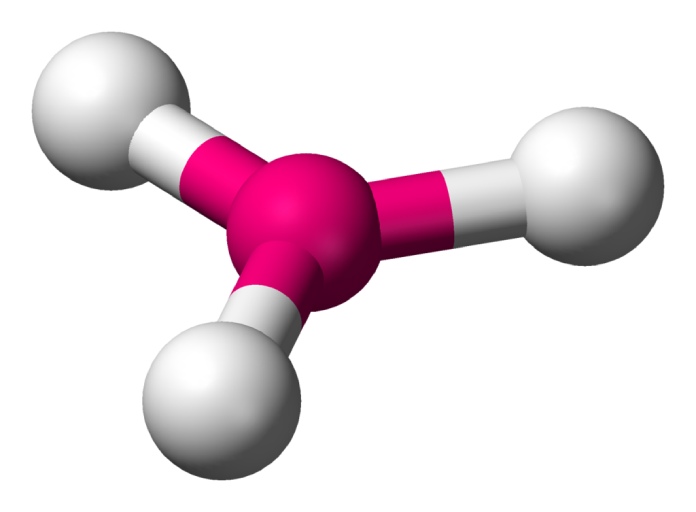
Trigonal piramidal (AX3E1)
Al sumarse un par de electrones no vinculantes a una estructura de tres átomos unidos a uno central, se forma una figura tridimensional similar a una pirámide. El ángulo descrito es de 107° aproximadamente. El PCl3 es un ejemplo adecuado.
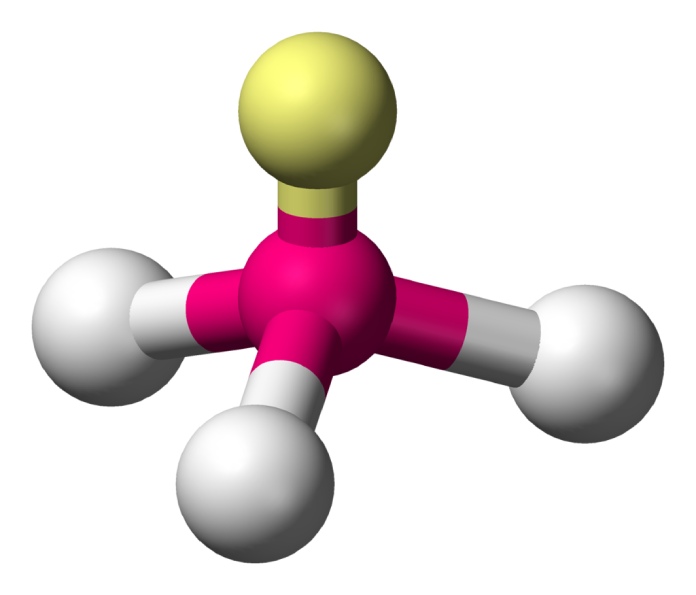
Trigonal T (AX3E2)
La forma de T describe la geometría de una molécula formada por un átomo central y tres átomos vinculados, que cuentan además con dos pares de electrones libres, los cuales empujan a los demás elementos en esta orientación. Un ejemplo de esta estructura puede ser el Trifloruro de bromo (BrF3).
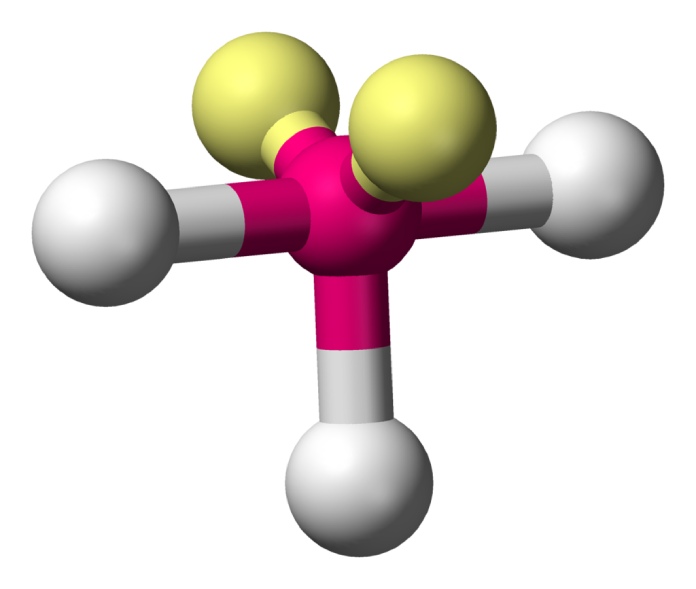
Tetraédrica (AX4E0)
Se puede llegar a pensar que una estructura de cuatro átomos unidos a un átomo central formaría una geometría plana similar a la trigonal, pero esto deja un problema de diseño, ya que algunos átomos se separarían 180° y otros solo 90°. Por consiguiente, la fórmula que mejor se adapta a la teoría es aquella en la que uno de los átomos toma la posición superior de la figura y los tres restantes se ubican como base, similar a una pirámide alargada. Así todos describen 109,5° aproximadamente de separación, como en el caso del CH4.
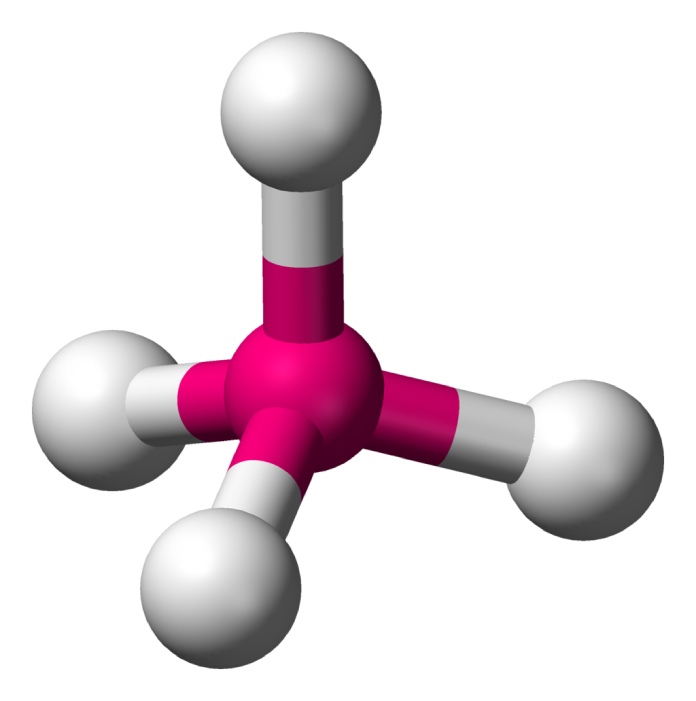
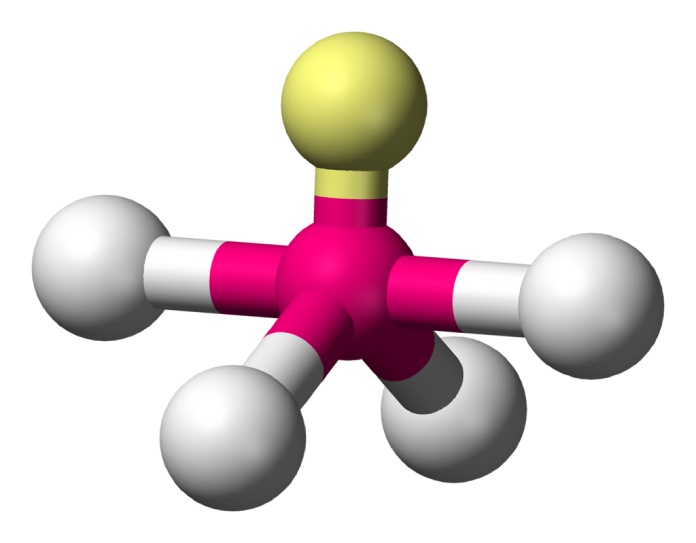
Balancín (AX4E1)
La estructura del balancín se forma con cuatro átomos vinculados a un átomo central y un par de electrones libres como pasa con el Tetrafluoruo de azufre (SF4). El par libre empuja a dos de los átomos hacia abajo, mientras que el resto describe una línea.
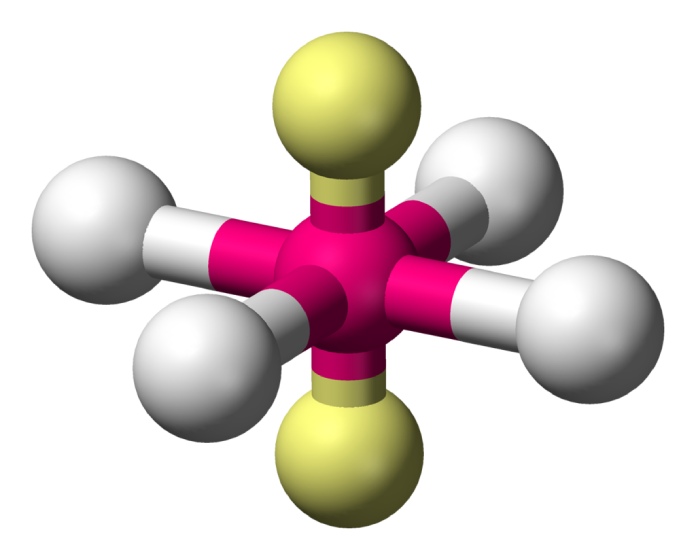
Cuadrada plana (AX4E2)
La fórmula cuadrada plana se consigue en aquellas moléculas cuya unión de átomos describa una estructura de cuatro unidos a uno central y dos pares de electrones libres. Así, los pares libres se ubican en polos opuestos de la estructura y equilibran la repulsión de los demás átomos, dejando una estructura plana (bidimensional) de 90° como en el caso del XeF4.
Aunque esta haya sido una aproximación teoría muy básica y resumida para el entendimiento de todos, es muy fácil ver como la geometría molecular y eléctrica es simplemente un reflejo de la perfección de la naturaleza. Gracias a este saber, los expertos pueden jugar con una estructura molecular y construir, cual arquitectos, complejas moléculas capaces de hacer cosas increíbles.